艾伟拓(上海)医药科技有限公司
12 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.7000000000000002
- 1.7000000000000002
- 0.7000000000000002
- 3.7
推荐产品
技术文档/正文
BioNTech在新冠疫苗生产中对RNase free HEPES缓冲体系的应用分析
716 人阅读发布时间:2023-08-24 14:42
一、辉瑞/BioNTech在新冠mRNA疫苗生产过程中使用RNase free的HEPES
辉瑞/BioNTech新冠疫苗EMA审评报告中的“制造过程和过程控制的描述”部分提到,BNT162b2活性物质的制造过程包括五个主要步骤。RNA分子通过体外转录(IVT)步骤从线性DNA合成,IVT步骤之后是多步净化和过滤。最后,RNA经过最后的过滤并被分装并冷冻储存。
报告建议申请人实施相关测试策略,以确保对起始材料进行充分的微生物控制,同时确保包含在FP的缓冲液配方中的HEPES(辉瑞)原材料不含RNA酶污染。
而在报告的“产品的制造和过程控制”下的“辅料控制”部分提到,加工助剂乙醇和柠檬酸缓冲液按Ph. Eur标准控制。HEPES和EDTA的标准参照活性物质制定。
由以上内容可知,辉瑞/BioNTech在新冠mRNA疫苗的生产过程中使用到HEPES,同时审评报告反复强调了该辅料的无RNase的关键属性。
结合2016年BioNTech发表LPX-mRNA制剂的文章中mRNA原液中所采用的buffer为HEPES,基本可以推断BioNTech采用HEPES作为原液中的buffer且已获批上市的新冠疫苗原液采用HEPES作为缓冲对。
二、HEPES作为IVT反应buffer的相关研究
mRNA原液中采用HEPES作为buffer可能与前一步RNA聚合酶体外转录密切相关。
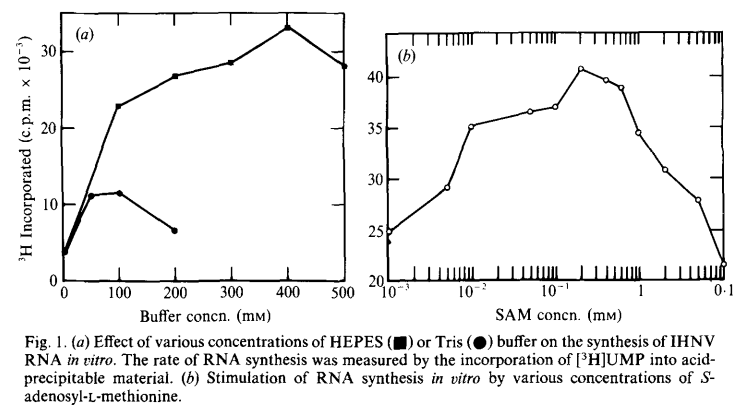
早在1987年便有研究报道使用HEPES缓冲对用于体外转录,在该研究中考察了不同反应条件下IHNV(感染性造血坏死病毒)的 RNA 聚合酶的体外转录,研究结果表明对比Tris,使用HEPES缓冲液可以最大限度地提高体外转录(IVT)效率。


辉瑞/BioNTech新冠疫苗EMA审评报告中的“制造过程和过程控制的描述”部分提到,BNT162b2活性物质的制造过程包括五个主要步骤。RNA分子通过体外转录(IVT)步骤从线性DNA合成,IVT步骤之后是多步净化和过滤。最后,RNA经过最后的过滤并被分装并冷冻储存。
报告建议申请人实施相关测试策略,以确保对起始材料进行充分的微生物控制,同时确保包含在FP的缓冲液配方中的HEPES(辉瑞)原材料不含RNA酶污染。
而在报告的“产品的制造和过程控制”下的“辅料控制”部分提到,加工助剂乙醇和柠檬酸缓冲液按Ph. Eur标准控制。HEPES和EDTA的标准参照活性物质制定。
由以上内容可知,辉瑞/BioNTech在新冠mRNA疫苗的生产过程中使用到HEPES,同时审评报告反复强调了该辅料的无RNase的关键属性。
结合2016年BioNTech发表LPX-mRNA制剂的文章中mRNA原液中所采用的buffer为HEPES,基本可以推断BioNTech采用HEPES作为原液中的buffer且已获批上市的新冠疫苗原液采用HEPES作为缓冲对。
二、HEPES作为IVT反应buffer的相关研究
mRNA原液中采用HEPES作为buffer可能与前一步RNA聚合酶体外转录密切相关。
早在1987年便有研究报道使用HEPES缓冲对用于体外转录,在该研究中考察了不同反应条件下IHNV(感染性造血坏死病毒)的 RNA 聚合酶的体外转录,研究结果表明对比Tris,使用HEPES缓冲液可以最大限度地提高体外转录(IVT)效率。


该研究中对缓冲条件的研究表明,HEPES缓冲液刺激的RNA合成量比Tris缓冲液高三倍(图1 a),最佳浓度的HEPES缓冲液为400mM。
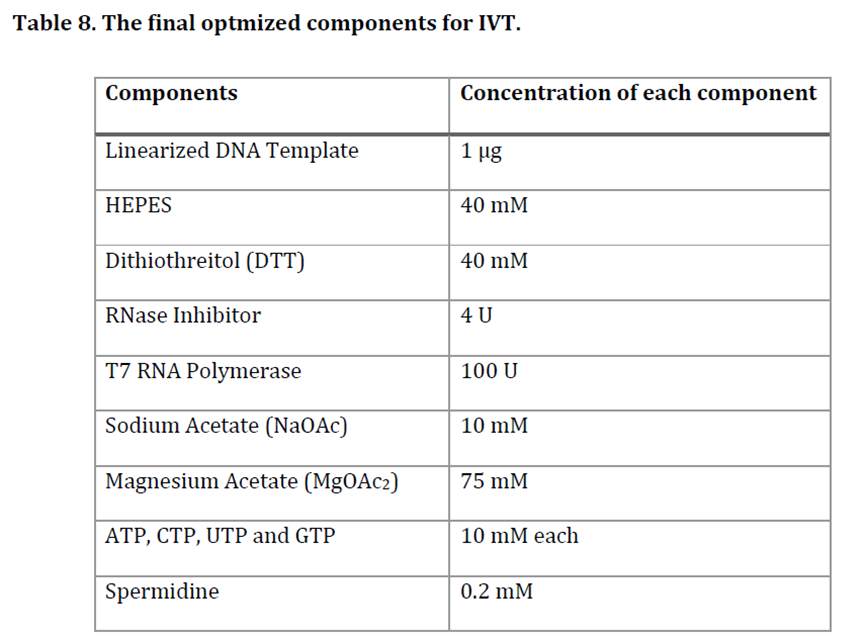
英国帝国理工大学医学院传染病系系主任Robin Shattock是mRNA预防性疫苗领域的权威专家,与BioNTech以及PNI等公司都有较为密切的合作。其团队2021年发表关于saRNA体外转录体系优化的文章中,考察筛选了影响saRNA体外转录的关键影响因素,最终确定了采用40mM浓度的HEPES作为IVT反应体系buffer,具有更优的体外转录效果。
英国帝国理工大学医学院传染病系系主任Robin Shattock是mRNA预防性疫苗领域的权威专家,与BioNTech以及PNI等公司都有较为密切的合作。其团队2021年发表关于saRNA体外转录体系优化的文章中,考察筛选了影响saRNA体外转录的关键影响因素,最终确定了采用40mM浓度的HEPES作为IVT反应体系buffer,具有更优的体外转录效果。

2016年BioNTech发表LPX-mRNA制剂的文章中mRNA原液中所采用的buffer为HEPES。该研究中使用HEPES缓冲液配置1mg/ml的RNA原液,用于进一步制备RNA-LPX。

HEPES作为IVT反应体系buffer具有优势,这是我们结合相关文献,推断BioNTech采用HEPES缓冲对作为mRNA原液buffer的原因。
三、HEPES相较于其他缓冲体系较为突出的特点
1、pKa随温度变化非常小,buffer的pH值随温度漂移很小。
2、性质稳定,HEPES不会与其他离子发生相互作用,一方面HEPES不会与其他离子发生络合影响其他离子功能,另外一方面其他离子的存在不会影响HEPES的缓冲能力。
3、细胞培养基中pH的维持主要依靠培养基中的碳酸氢盐和5%的CO2共同维持,当细胞处于开放环境时,CO2逸散会导致pH快速上升脱离生理pH范围,而添加HEPES缓冲对的培养基则不存在这方面问题。
4、HEPES不易穿过生物膜,不干扰细胞内的生化反应。
四、使用HEPES缓冲体系时的注意事项
1、由于哌嗪基团的存在,当HEPES暴露于光线中时,会产生H2O2,这对培养的细胞或其它有生物活性的物体产生毒性,同时对氧化还原敏感的物质不宜共同使用,因此HEPES作为缓冲液的操作应尽量在避光条件下进行。
2、HEPES在生化领域常见的使用浓度为10-25mM,当浓度低于10mM时缓冲能力较弱,不能起到较好的缓冲效果,当浓度较高时对一些细胞可能具有毒害作用。
艾伟拓长期稳定供应注射级海藻糖、蔗糖、TRIS/TRIS-HCl、HEPES等生物保护剂与缓冲盐,GMP条件生产,中美双报,供注射用,超低内毒素,DNase& RNase free,符合国际主流药典标准,助力重组蛋白疫苗、mRNA疫苗、腺病毒载体疫苗、脂质体、单双抗、抗体偶联药物等生物制剂生产与中外申报!
三、HEPES相较于其他缓冲体系较为突出的特点
1、pKa随温度变化非常小,buffer的pH值随温度漂移很小。
2、性质稳定,HEPES不会与其他离子发生相互作用,一方面HEPES不会与其他离子发生络合影响其他离子功能,另外一方面其他离子的存在不会影响HEPES的缓冲能力。
3、细胞培养基中pH的维持主要依靠培养基中的碳酸氢盐和5%的CO2共同维持,当细胞处于开放环境时,CO2逸散会导致pH快速上升脱离生理pH范围,而添加HEPES缓冲对的培养基则不存在这方面问题。
4、HEPES不易穿过生物膜,不干扰细胞内的生化反应。
四、使用HEPES缓冲体系时的注意事项
1、由于哌嗪基团的存在,当HEPES暴露于光线中时,会产生H2O2,这对培养的细胞或其它有生物活性的物体产生毒性,同时对氧化还原敏感的物质不宜共同使用,因此HEPES作为缓冲液的操作应尽量在避光条件下进行。
2、HEPES在生化领域常见的使用浓度为10-25mM,当浓度低于10mM时缓冲能力较弱,不能起到较好的缓冲效果,当浓度较高时对一些细胞可能具有毒害作用。
艾伟拓长期稳定供应注射级海藻糖、蔗糖、TRIS/TRIS-HCl、HEPES等生物保护剂与缓冲盐,GMP条件生产,中美双报,供注射用,超低内毒素,DNase& RNase free,符合国际主流药典标准,助力重组蛋白疫苗、mRNA疫苗、腺病毒载体疫苗、脂质体、单双抗、抗体偶联药物等生物制剂生产与中外申报!