艾伟拓(上海)医药科技有限公司
12 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.7999999999999998
- 1.7999999999999998
- 0.7999999999999998
- 3.8
推荐产品
新闻中心/正文
【药辅法规汇总】6月份相关法规汇总(下)
771 人阅读发布时间:2019-12-22 18:57
本期艾伟拓小编给大家带来了6月份药用辅料相关法律法规汇总(下),跟随小编一起来看一下有哪些政策出台吧。
来源:药典委
1、关于橄榄油国家药用辅料标准修订草案的公示
发布日期:6月18日
网址:http://www.chp.org.cn/view/ff8080816a583947016b68a7c56a2584?a=BZFULIAO
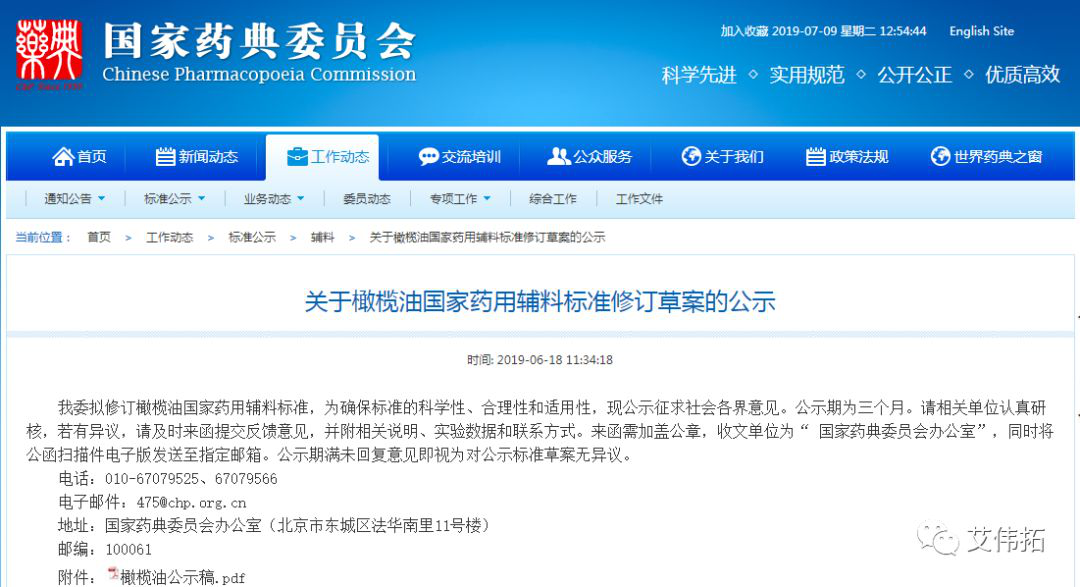
我委拟修订橄榄油国家药用辅料标准,为确保标准的科学性、合理性和适用性,现公示征求社会各界意见。公示期为三个月。请相关单位认真研核,若有异议,请及时来函提交反馈意见,并附相关说明、实验数据和联系方式。来函需加盖公章,收文单位为“ 国家药典委员会办公室”,同时将公函扫描件电子版发送至指定邮箱。公示期满未回复意见即视为对公示标准草案无异议。
2、关于《中国药典》2020年版四部通则增修订内容(第十四批)的公示
发布日期:7月1日
网址:http://www.chp.org.cn/view/ff8080816a583947016babf7fd8e0f03?a=BZFL
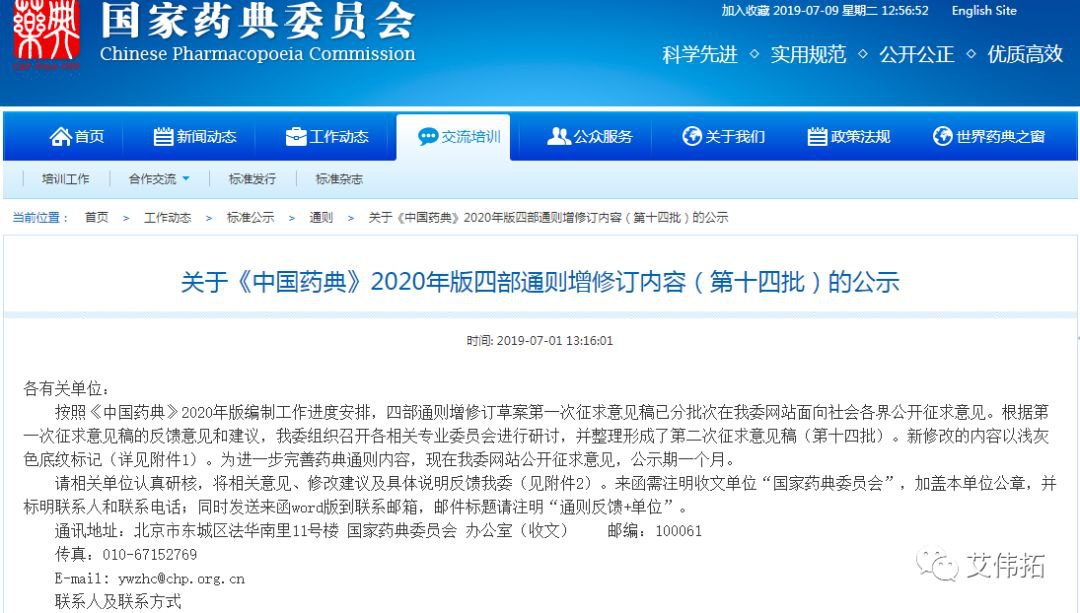
各有关单位:
按照《中国药典》2020年版编制工作进度安排,四部通则增修订草案第一次征求意见稿已分批次在我委网站面向社会各界公开征求意见。根据第一次征求意见稿的反馈意见和建议,我委组织召开各相关专业委员会进行研讨,并整理形成了第二次征求意见稿(第十四批)。新修改的内容以浅灰色底纹标记(详见附件1)。为进一步完善药典通则内容,现在我委网站公开征求意见,公示期一个月。
3、关于《中国药典》2020年版四部通则增修订内容(第十五批)的公示
发布日期:7月1日
网址:http://www.chp.org.cn/view/ff8080816a583947016bab9779ae0e9b?a=BZFL
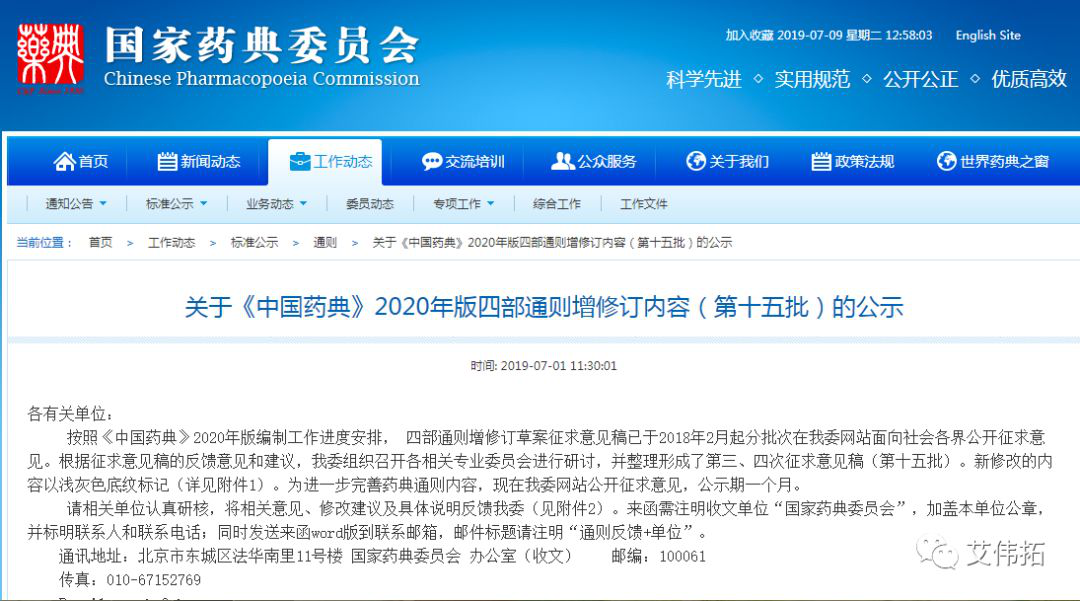
各有关单位:
按照《中国药典》2020年版编制工作进度安排, 四部通则增修订草案征求意见稿已于2018年2月起分批次在我委网站面向社会各界公开征求意见。根据征求意见稿的反馈意见和建议,我委组织召开各相关专业委员会进行研讨,并整理形成了第三、四次征求意见稿(第十五批)。新修改的内容以浅灰色底纹标记(详见附件1)。为进一步完善药典通则内容,现在我委网站公开征求意见,公示期一个月。
4、关于做好2019年度国家药品标准提高工作的通知
发布日期:6月18日
网址:http://www.chp.org.cn/view/ff8080816a583947016b690f92c425da?a=GZW
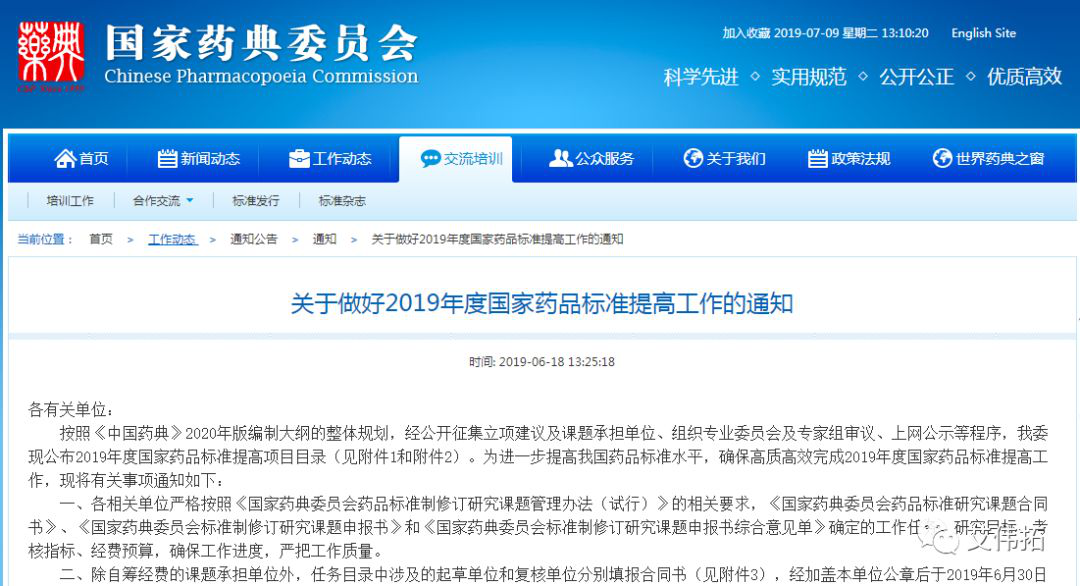
各有关单位:
按照《中国药典》2020年版编制大纲的整体规划,经公开征集立项建议及课题承担单位、组织专业委员会及专家组审议、上网公示等程序,我委现公布2019年度国家药品标准提高项目目录(见附件1和附件2)。为进一步提高我国药品标准水平,确保高质高效完成2019年度国家药品标准提高工作,现将有关事项通知如下
CDE
1、关于发布仿制药参比制剂目录(第二十一批)的通告(2019年 第34号
发布日期:6月13日
网址:http://www.nmpa.gov.cn/WS04/CL2138/338260.html
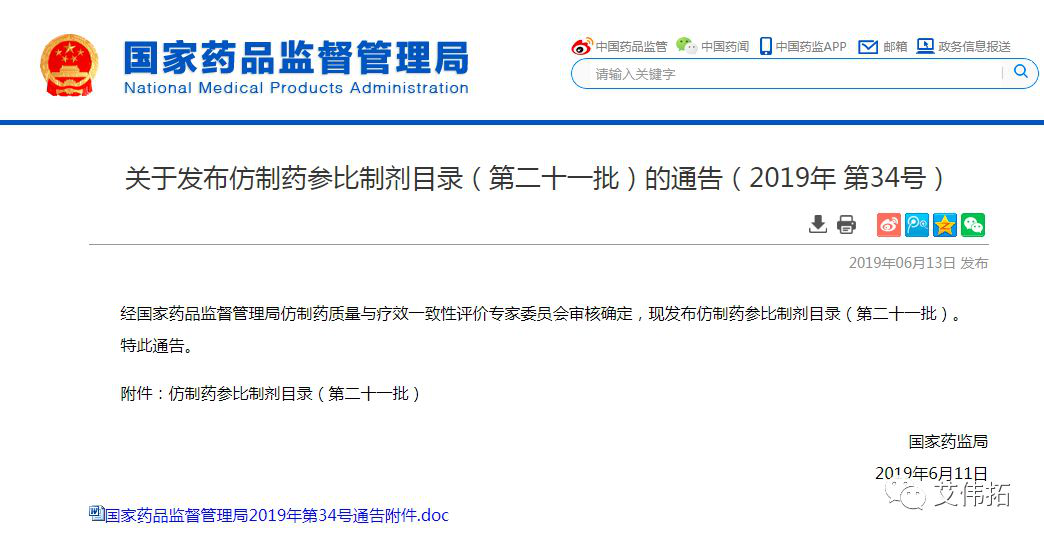
经国家药品监督管理局仿制药质量与疗效一致性评价专家委员会审核确定,现发布仿制药参比制剂目录(第二十一批)。
2、关于规范电子资料提交文件格式的通知
发布日期:7月2日
网址:http://www.cde.org.cn/news.do?method=viewInfoCommon&id=314887
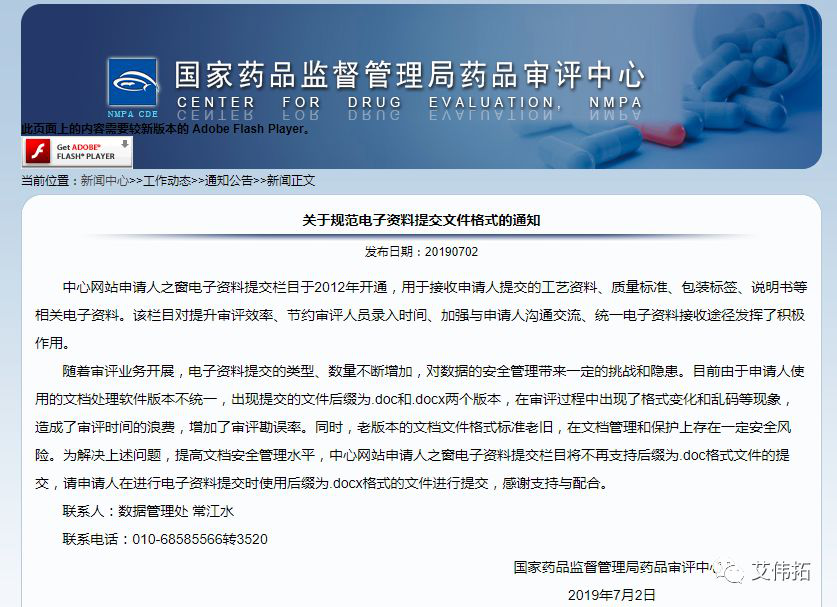
中心网站申请人之窗电子资料提交栏目于2012年开通,用于接收申请人提交的工艺资料、质量标准、包装标签、说明书等相关电子资料。该栏目对提升审评效率、节约审评人员录入时间、加强与申请人沟通交流、统一电子资料接收途径发挥了积极作用。
NMPA
1、关于发布上市药品临床安全性文献评价指导原则(试行)的通告(2019年第27号)
发布日期:6月18日
网址:http://www.nmpa.gov.cn/WS04/CL2138/338318.html
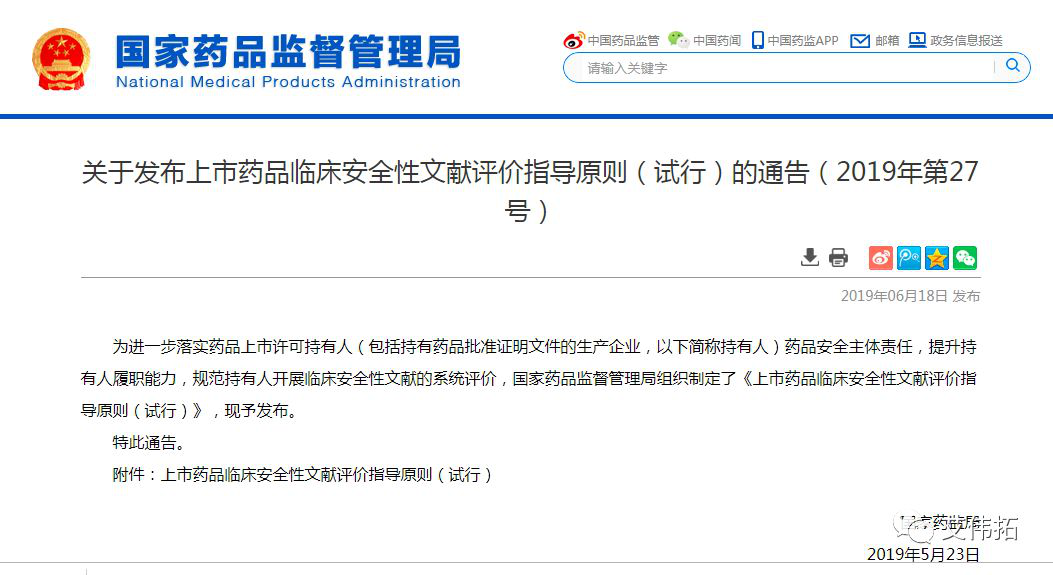
为进一步落实药品上市许可持有人(包括持有药品批准证明文件的生产企业,以下简称持有人)药品安全主体责任,提升持有人履职能力,规范持有人开展临床安全性文献的系统评价,国家药品监督管理局组织制定了《上市药品临床安全性文献评价指导原则(试行)》,现予发布。
2、2018年度药品审评报告
发布日期:7月1日
网址:http://www.nmpa.gov.cn/WS04/CL2196/338621.html
2018年,国家药品监督管理局药品审评中心(以下简称药审中心)在国家药品监督管理局(以下简称国家局)坚强领导下,继续贯彻落实中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号,以下简称42号文件)和国务院《关于改革药品医疗器械审评审批制度的意见》
来源:药典委
1、关于橄榄油国家药用辅料标准修订草案的公示
发布日期:6月18日
网址:http://www.chp.org.cn/view/ff8080816a583947016b68a7c56a2584?a=BZFULIAO

我委拟修订橄榄油国家药用辅料标准,为确保标准的科学性、合理性和适用性,现公示征求社会各界意见。公示期为三个月。请相关单位认真研核,若有异议,请及时来函提交反馈意见,并附相关说明、实验数据和联系方式。来函需加盖公章,收文单位为“ 国家药典委员会办公室”,同时将公函扫描件电子版发送至指定邮箱。公示期满未回复意见即视为对公示标准草案无异议。
2、关于《中国药典》2020年版四部通则增修订内容(第十四批)的公示
发布日期:7月1日
网址:http://www.chp.org.cn/view/ff8080816a583947016babf7fd8e0f03?a=BZFL

各有关单位:
按照《中国药典》2020年版编制工作进度安排,四部通则增修订草案第一次征求意见稿已分批次在我委网站面向社会各界公开征求意见。根据第一次征求意见稿的反馈意见和建议,我委组织召开各相关专业委员会进行研讨,并整理形成了第二次征求意见稿(第十四批)。新修改的内容以浅灰色底纹标记(详见附件1)。为进一步完善药典通则内容,现在我委网站公开征求意见,公示期一个月。
3、关于《中国药典》2020年版四部通则增修订内容(第十五批)的公示
发布日期:7月1日
网址:http://www.chp.org.cn/view/ff8080816a583947016bab9779ae0e9b?a=BZFL

各有关单位:
按照《中国药典》2020年版编制工作进度安排, 四部通则增修订草案征求意见稿已于2018年2月起分批次在我委网站面向社会各界公开征求意见。根据征求意见稿的反馈意见和建议,我委组织召开各相关专业委员会进行研讨,并整理形成了第三、四次征求意见稿(第十五批)。新修改的内容以浅灰色底纹标记(详见附件1)。为进一步完善药典通则内容,现在我委网站公开征求意见,公示期一个月。
4、关于做好2019年度国家药品标准提高工作的通知
发布日期:6月18日
网址:http://www.chp.org.cn/view/ff8080816a583947016b690f92c425da?a=GZW

各有关单位:
按照《中国药典》2020年版编制大纲的整体规划,经公开征集立项建议及课题承担单位、组织专业委员会及专家组审议、上网公示等程序,我委现公布2019年度国家药品标准提高项目目录(见附件1和附件2)。为进一步提高我国药品标准水平,确保高质高效完成2019年度国家药品标准提高工作,现将有关事项通知如下
CDE
1、关于发布仿制药参比制剂目录(第二十一批)的通告(2019年 第34号
发布日期:6月13日
网址:http://www.nmpa.gov.cn/WS04/CL2138/338260.html

经国家药品监督管理局仿制药质量与疗效一致性评价专家委员会审核确定,现发布仿制药参比制剂目录(第二十一批)。
2、关于规范电子资料提交文件格式的通知
发布日期:7月2日
网址:http://www.cde.org.cn/news.do?method=viewInfoCommon&id=314887

中心网站申请人之窗电子资料提交栏目于2012年开通,用于接收申请人提交的工艺资料、质量标准、包装标签、说明书等相关电子资料。该栏目对提升审评效率、节约审评人员录入时间、加强与申请人沟通交流、统一电子资料接收途径发挥了积极作用。
NMPA
1、关于发布上市药品临床安全性文献评价指导原则(试行)的通告(2019年第27号)
发布日期:6月18日
网址:http://www.nmpa.gov.cn/WS04/CL2138/338318.html

为进一步落实药品上市许可持有人(包括持有药品批准证明文件的生产企业,以下简称持有人)药品安全主体责任,提升持有人履职能力,规范持有人开展临床安全性文献的系统评价,国家药品监督管理局组织制定了《上市药品临床安全性文献评价指导原则(试行)》,现予发布。
2、2018年度药品审评报告
发布日期:7月1日
网址:http://www.nmpa.gov.cn/WS04/CL2196/338621.html

2018年,国家药品监督管理局药品审评中心(以下简称药审中心)在国家药品监督管理局(以下简称国家局)坚强领导下,继续贯彻落实中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号,以下简称42号文件)和国务院《关于改革药品医疗器械审评审批制度的意见》