艾伟拓(上海)医药科技有限公司
12 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.7999999999999998
- 1.7999999999999998
- 0.7999999999999998
- 3.8
推荐产品
新闻中心/正文
制剂变更辅料甘油供应商怎么做?
829 人阅读发布时间:2019-12-22 18:40
看到本文标题,小伙伴们应该就知道艾伟拓小编今天会和大家聊什么了,那么,制剂变更甘油供应商应该怎么做呢?跟随小编一起来看一下吧。
国家药监局关于进一步完善药品关联审评审批和监管工作有关事宜的公告(2019年 第56号)已于2019年8月15日正式生效。对于上市药品制剂变更辅料供应商的规定,可参见该公告(十七)条“已上市药品制剂变更原辅包及原辅包供应商的,应按照《已上市化学药品变更研究技术指导原则(一)》《已上市化学药品生产工艺变更研究技术指导原则》《已上市中药变更研究技术指导原则(一)》及生物制品上市后变更研究相关指导原则等要求开展研究,并按照现行药品注册管理有关规定执行。”
根据《总局关于调整原料药、药用辅料和药包材审评审批事项的公告》(2017年146号文) 第十条,制剂申请人充分研究和评估原料药、药用辅料和药包材变更对其产品质量的影响,按照国家食品药品监督管理总局有关规定和相关指导原则进行研究,按要求提出变更申请或者进行备案。
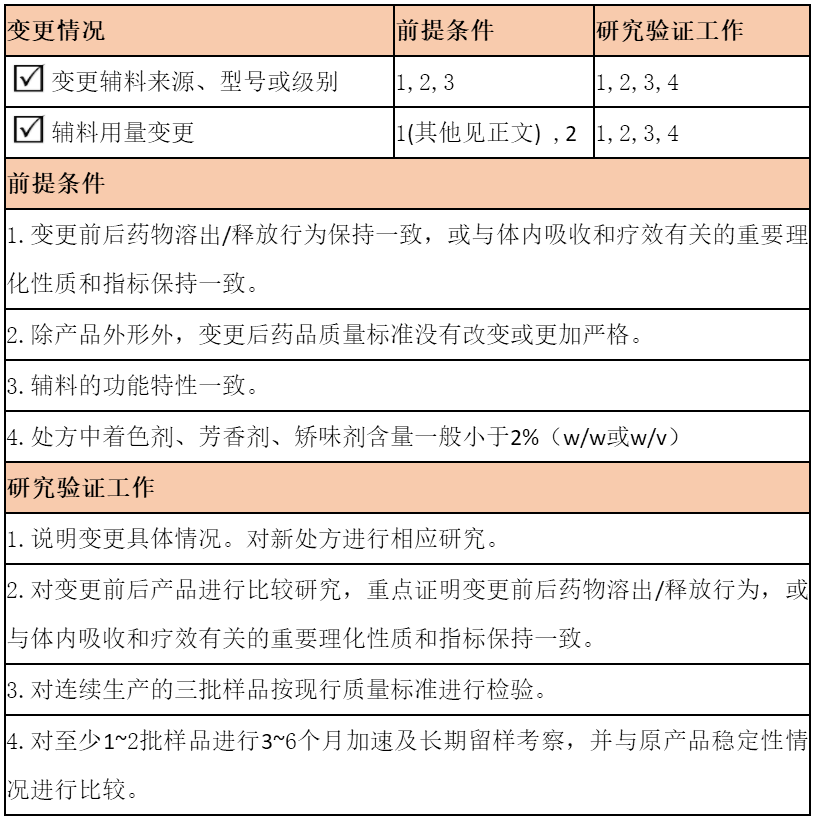
甘油作为药用辅料在化学药品里常用于润滑剂、助悬剂、渗透压调节剂等,已收载于2015年版中国药典。在产品质量要求不变的情况下,其供应商的变更属于影响较小的Ⅱ类变更。然而,变更究竟走备案还是变更申请还与甘油的登记状态有关。
1.状态为A的
表明该产品已经经过至少一次审评,在给药途径和添加量不变的情况下,根据以上两个变更研究技术指导原则,进行相关研究后,在省局进行备案即可。
如给药途径和添加量与之前关联制剂不一致的,药品申请人应自行评估风险,备案或者提出变更申请。
2.状态为I的
表明该产品登记公示后尚未通过审评,变更需报补充申请,通过CDE关联审评审批后方可。
国家药监局关于进一步完善药品关联审评审批和监管工作有关事宜的公告(2019年 第56号)已于2019年8月15日正式生效。对于上市药品制剂变更辅料供应商的规定,可参见该公告(十七)条“已上市药品制剂变更原辅包及原辅包供应商的,应按照《已上市化学药品变更研究技术指导原则(一)》《已上市化学药品生产工艺变更研究技术指导原则》《已上市中药变更研究技术指导原则(一)》及生物制品上市后变更研究相关指导原则等要求开展研究,并按照现行药品注册管理有关规定执行。”
根据《总局关于调整原料药、药用辅料和药包材审评审批事项的公告》(2017年146号文) 第十条,制剂申请人充分研究和评估原料药、药用辅料和药包材变更对其产品质量的影响,按照国家食品药品监督管理总局有关规定和相关指导原则进行研究,按要求提出变更申请或者进行备案。
甘油作为药用辅料在化学药品里常用于润滑剂、助悬剂、渗透压调节剂等,已收载于2015年版中国药典。在产品质量要求不变的情况下,其供应商的变更属于影响较小的Ⅱ类变更。然而,变更究竟走备案还是变更申请还与甘油的登记状态有关。
1.状态为A的
表明该产品已经经过至少一次审评,在给药途径和添加量不变的情况下,根据以上两个变更研究技术指导原则,进行相关研究后,在省局进行备案即可。
如给药途径和添加量与之前关联制剂不一致的,药品申请人应自行评估风险,备案或者提出变更申请。
2.状态为I的
表明该产品登记公示后尚未通过审评,变更需报补充申请,通过CDE关联审评审批后方可。