艾伟拓(上海)医药科技有限公司
12 年
手机商铺
- NaN
- 0.7999999999999998
- 1.7999999999999998
- 0.7999999999999998
- 3.8
推荐产品
新闻中心/正文
深度分析氨基酸在生物制剂中的应用机制
1033 人阅读发布时间:2024-07-01 12:53
氨基酸广泛用于提升蛋白质稳定性
在生命系统中,蛋白质存在于细胞液、血液或其他体液环境中,被各种溶质包围,可通过体积排阻效应来稳定自身。除了体积排阻效应外,生物大分子的稳定性还与多种因素有关。此外,一些蛋白质在本质上是不稳定的,因此,大多数蛋白质在水溶液中不稳定。必须进一步提升蛋白质稳定性,以便进行表征研究、药物研发、疾病治疗或其他用途。
常用的提升蛋白稳定性方法是添加高浓度的糖类、多元醇和氨基酸。治疗性蛋白质则需要更严格的条件来确保其长期储存的稳定性。这些稳定剂,也称作药用辅料,在提升蛋白质稳定性方面中起主要作用。
氨基酸在蛋白质的纯化、加工和储存中起着重要作用,基于以下两个观察结果:
(1)某些氨基酸,被称为“渗透物”或“相容性溶质”,因为当这些低分子量溶质暴露于高环境盐浓度时,它们会在细胞或生物体中不断积累以提高渗透压。选择这些渗透溶质而不是其他小分子是由于它们与细胞中的大分子结构和功能的相容性,因此它们被称为“相容性溶质”。相容溶质通常不会干扰酶的活性或蛋白质的功能结构。此外,它们不仅与大分子功能兼容,而且还增强了大分子,特别是蛋白质的稳定性。因此,氨基酸可以用来稳定蛋白质而不影响其功能。
(2)在干燥状态下,某些小分子在维持生物大分子天然结构方面是有效的。许多生物在脱水的情况下存活,这种现象被称为“低湿隐生”。这些生物在细胞内大量积累海藻糖。了解海藻糖保护这些生物体和细胞免受脱水影响的机制,使人们认识到需要某些添加剂来保护蛋白质免受冷冻和冷冻干燥等恶劣条件的影响,并增加蛋白质干燥状态下的储存稳定性。后续研究表明,氨基酸在冷冻或冷冻干燥状态下也可以为蛋白质的稳定提供保护作用。
2氨基酸是如何稳定蛋白质的
添加剂对蛋白质稳定性影响的机理有三个重要因素:
①溶剂组分与蛋白质的优先相互作用;
②添加剂对水结构(如水的表面张力)的影响;
③氨基酸添加剂对在水溶液中的氨基酸和多肽溶解度的影响。
那么,氨基酸是如何在溶液和干燥状态下稳定蛋白质的呢?
1. 溶液状态下,氨基酸主要通过自由能差异及表面张力稳定蛋白质
①自由能差异(ΔGu)
首先,我们考虑溶液状态。如上所述,蛋白质在水溶液中是略微稳定的,在脱离自然环境后很容易失去其结构和功能活性。这种蛋白质的结构和功能损失可以通过热力学(可逆)和动力学(不可逆)机制发生。
蛋白质的热力学稳定性由天然(有功能)和未折叠(变性,无功能)状态的自由能差异决定,如图1,展示了无结构稳定添加剂和有结构稳定添加剂时蛋白质不同状态的自由能图,其中ΔGu是两种状态下的自由能差异。ΔGu越大,天然蛋白越稳定。有两种机制可以增加ΔGu。
一种是降低天然态蛋白质(有功能)的自由能,如图1A所示。在这种情况下,任何优先结合到天然蛋白的配体,都应该降低天然蛋白的自由能,从而增加ΔGu的值。这些配体对天然蛋白具有特异性,包括底物、酶的抑制剂或辅助因子、金属结合蛋白的金属离子和细胞信号蛋白的信号分子。然而,这些都是蛋白质特异性的,这意味着稳定特定蛋白质的因素可能不会稳定其他蛋白质,甚至可能使某些蛋白质不稳定。
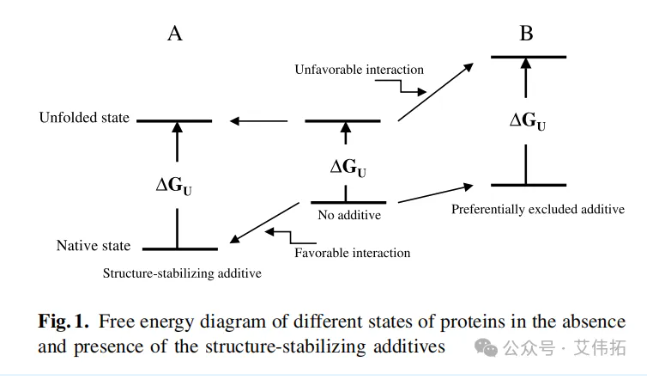
第二种机制是增加未折叠蛋白质的自由能(图1B)。
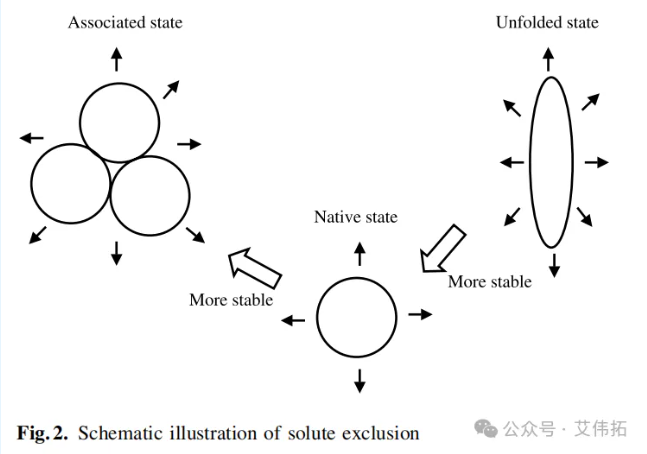
基于平衡透析的优先相互作用测量表明,这些稳定添加剂(溶质)不与天然蛋白质结合。它们的结合实际上是负的;也就是说,在蛋白质分子附近缺乏这些添加剂。这种情况如图2所示(用箭头表示溶质不相容)。不管稳定溶质(优先排除添加剂)从蛋白质表面明显排斥的原因是什么,蛋白质表面周围溶质缺乏(排除)的热力学后果是未折叠蛋白质自由能的增加(图1B),这是由于蛋白质展开后表面积增加,对比正常折叠的蛋白质,溶质排斥和负结合会更大,即蛋白质从正常折叠状态展开至未折叠状态需要更高的自由能。因此,稳定溶质的加入增加了天然状态蛋白质的自由能。
小结,在稳定溶质的存在下,未折叠态蛋白质的自由能增加,从而使天然结构蛋白质更为稳定(图1B和图2)。第一种(配体结合)和第二种(溶质排阻)机制的主要区别在于稳定溶质的优先相互作用与蛋白质无关。因此,这些溶质不与任何蛋白质的表面结合,也就是说,它们是普遍有效的蛋白质稳定剂。
②表面张力
常见的蛋白质稳定剂(如多元醇和糖)共有的一个特性是能够增加水溶液的表面张力。甘氨酸、丙氨酸等多种氨基酸也会增加水的表面张力。而研究表明,那些增加水表面张力的溶质在水和空气的界面中是缺乏的。
将这种关系延伸到蛋白质表面,预计在蛋白质表面附近会缺乏氨基酸分子。表面张力和溶质排斥之间的这种关系被描述为一种空腔理论,即在溶剂中形成容纳溶质分子(如蛋白质和核酸)空腔的表面自由能的能力在大分子的稳定和自结合中起着重要作用。
空腔理论被扩展到包括表面张力对蛋白质溶解度和疏水相互作用色谱的贡献,或疏水尺度的测量。这些氨基酸的优先相互作用测量表明,它们被排除在蛋白质表面之外,与对多元醇和糖的观察结果类似。正如负相互作用所预期的那样,这些氨基酸确实稳定了蛋白质。
表面张力反映了添加剂对水结构的影响,因此,当添加剂对蛋白质表面表现出亲和力时,表面张力与添加剂的影响无关。
很明显,小分子发挥其稳定作用的能力取决于水的存在,而水在冷冻过程中和冷冻后仍然存在。蛋白质表面周围总是有不结冰的水,这些水与蛋白质结合在一起。但需要注意的是,同样的原理不适用于干燥状态下的蛋白质,因为水被除去了。
2.干燥状态下,氨基酸主要通过水替代作用稳定蛋白质
在冷冻干燥过程和干燥状态下,小分子的存在对蛋白质是必不可少的。与许多在溶液中或抗冻中起作用的小分子添加剂相比,在干燥状态下,有限数量的小分子是有效的。它们是如何实现这种稳定的?一种机制是水替代。
蛋白质结合许多水分子,这些水分子在干燥过程中被去除,因此参与水结合的残基与其他残基发生分子间或分子内的氢键,从而导致蛋白质分子的展开或聚集。糖可以代替水形成氢键,导致糖和蛋白质表面形成氢键。在干燥状态下,化学反应和展开的速度是由蛋白质和周围分子的流动性决定的。这种流动性在干燥状态的玻璃状状态下大大降低,在糖的存在下可以更稳定。
艾伟拓4款注射级氨基酸辅料已全部完成主流药典(USP,EP,ChP等)符合性研究,更在关键指标上实现超越,全面对标一线进口品牌,已广泛供应众多生物医药企业,为生物制剂的稳定性和安全性保驾护航,为国产创新药的中外申报提供助力!
★精氨酸(供注射用)
(CDE登记号:F20230000160,DMF号:039677);
★组氨酸(供注射用)
(CDE登记号:F20230000159);
★盐酸精氨酸(供注射用)
(CDE登记号:F20230000161,DMF号:038726);
★盐酸组氨酸(供注射用)
(CDE登记号:F20220000547,DMF:038369)
艾伟拓致力于为客户提供更优质的服务,不仅提供药典符合性声明,还能单独出具符合具体药典标准的检测报告(COA)。