艾伟拓(上海)医药科技有限公司
12 年
手机商铺
- NaN
- 0.7999999999999998
- 1.7999999999999998
- 0.7999999999999998
- 3.8
推荐产品
新闻中心/正文
文献速递 | 羟基-PEG化LNP共递送siRNA&mRNA用于治疗乙肝病毒感染
426 人阅读发布时间:2024-09-09 13:02
乙型肝炎病毒(Hepatitis B virus,HBV)感染可导致慢性乙型肝炎(CHB)、肝纤维化、肝硬化和肝细胞癌(HCC)。据世卫组织统计,2022年约有2.54亿人感染慢性乙肝,新增120万感染病例。此外,2022年乙肝导致约110万人死亡,主要缘于肝硬化和肝细胞癌(原发性肝癌)。HBV是严重危害人类健康的公共卫生问题,但目前可选择的治疗方案十分有限。
HBV基因组是一个松弛环状DNA(rcDNA),包含4个重叠的开放阅读框,分别为S、C、P和X(图1),进入宿主细胞核会被内源性酶修复成共价闭合环状DNA(cccDNA),cccDNA编码核心抗原(HBcAg)、表面抗原(HBsAg)、e抗原(HBeAg)和X蛋白(HBx)4个重叠的开放阅读框(ORFs),也是HBeAg阳性患者HBsAg的主要来源。此外,不能复制的HBV线性片段可以整合到宿主基因组中(intHBV),整合HBV DNA是HBeAg阴性患者HBsAg的主要来源。CHB患者理想的治疗终点是HBsAg持续阴性和/或抗HBs阳性,但由于完全清除cccDNA和整合HBV DNA是无法实现,因此CHB的治疗目标是在有限疗程内的持续治疗实现HBsAg血清的清除。
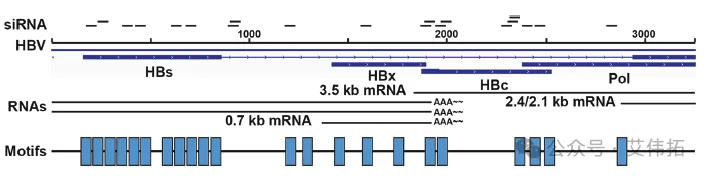
图1 HBV RNAs的结构和siRNA候选位置
RNA干扰(RNAi)技术可以通过诱导抗原抑制、减轻病毒血症和沉默cccDNA来实现HBV的功能性治愈,因此这一技术在治疗遗传疾病和病毒感染方面显示出巨大的应用前景。然而,考虑到HBV的10种不同基因型(A到J)之间有较高的遗传多样性,设计针对HBV的功能性siRNA具有很大的挑战性。
随着针对 COVID-19 的mRNA疫苗的成功以及多种 RNAi药物的批准,RNA 医学时代已成为现实。大量的研究集中在开发递送系统,如脂质纳米颗粒(LNPs)、与N-乙酰半乳糖胺(GalNAc)的化学缀合等,以增强 RNAi 疗法的不良细胞摄取和不足的药代动力学特性,从而提高其功效和安全性。然而,目前的RNAi治疗大多仅限于肝脏疾病,受到肝脏靶向的严重限制。因此,RNAi治疗靶向肝外组织并最终扩展其治疗各种疑难杂症,存在巨大的未满足的医疗需求。
综上,迫切需要设计广泛针对HBV多种基因型并同时抑制HBsAg表达和cccDNA转录的siRNA以及开发安全高效的递送系统,以提高乙肝病毒感染治疗效果。
脂质纳米颗粒(LNPs)通常可电离的阳离子脂质、胆固醇、聚乙二醇化脂质(PEG lipids)和辅助脂质组成。该课题组前期研究发现,羟基-PEG化LNPs可显著降低与人体血液中存在的抗PEG抗体的吸附及其后续补体激活,抗原性较甲氧基-PEG化LNPs更弱,一定程度上避免产生PEG特异性抗体,使LNPs逃逸抗体识别和快速清除。
RNAi和抗体介导的HBsAg清除可以通过降低HBV病毒负荷来消除免疫功能障碍,但无法激活病毒特异性T细胞来实现对病毒的长期控制。有研究表明,IL-2是实现病毒抗原呈递以及特异性CD4+和CD8+T细胞的激活和分化的关键调控因子。低剂量IL-2与IFN-α的序贯给药可增加HBV患者体内特异性CD8+T细胞反应的频率并恢复其功能。研究团队认为,通过RNAi疗法来抑制HBV病毒载量,同时使用IL-2来增强宿主免疫,可能足以打破免疫耐受,重建抗病毒免疫。
基于以上背景及发现,复旦大学袁正宏、占昌友及上海交通大学付炜等研究团队在 《Signal Transduction and Targeted Therapy 》上发表了题为“Optimized RNA interference therapeutics combined with interleukin-2 mRNA for treating hepatitis B virus infection ”的创新性研究成果。该团队筛选并修饰了一种针对HBV全基因型和全靶点的多功能siRNA组合药物(siHBV),使用自主开发的新型脂质纳米粒递送系统(tLNP)实现其在动物体内高效安全的肝靶向输送(tLNP/siHBV)。此外,该研究开发了一种治疗HBV的联合疗法,使用tLNP共载siHBV与IL-2 mRNA(tLNP/siHBVIL2)。以上成果为推动HBV感染治疗领域发展提供了新的策略。
1
功能性siRNA的设计、筛选和体外评价
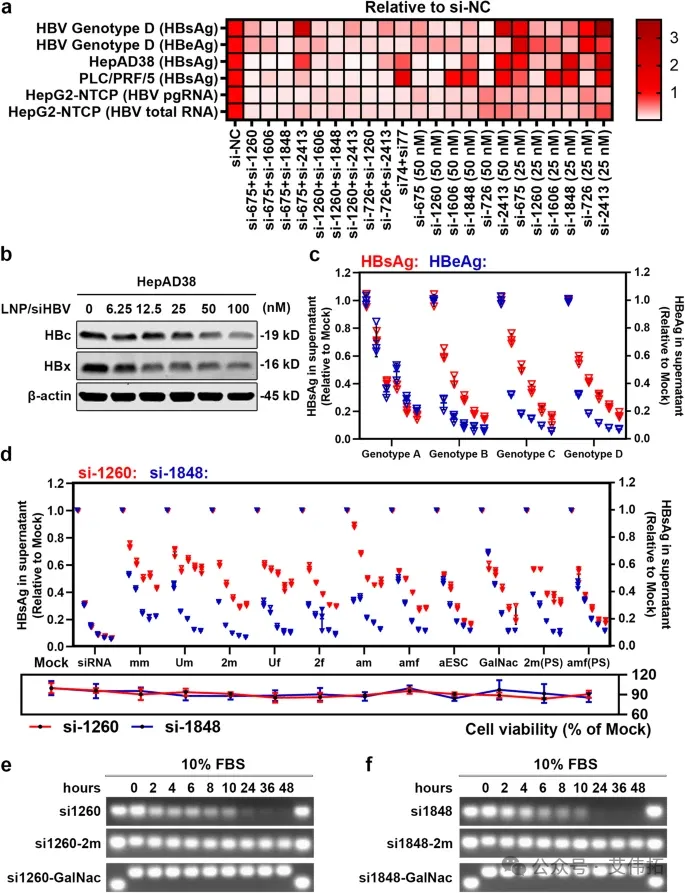
研究团队对HBV基因组进行了测序分析, 设计并筛选可针对HBV高保守序列、同时高效抑制HBsAg、整合HBV DNA和HBx的一系列siRNA。在两种HBV相关细胞模型中评价序列及序列组合功效,并对其生物活性、细胞毒性和血清稳定性进行了检测,最终筛选得到优选的序列组合(si-1260和si-1848的组合,简称“siHBV”)。siHBV具有广泛的基因型覆盖率(98.55%)和靶点覆盖率(所有cccDNA及intHBV来源的HBV RNA)、较低的脱靶效应和细胞毒性,为HBV治疗提供了一种具有显著优势的新siRNA候选药物。
2
新型脂质纳米粒递送系统(tLNP)
配方的筛选和评价
研究团队基于前期发现,使用新型脂质纳米粒递送系统(tLNP):对PEG脂质进行羟基修饰的同时,进一步优化了其在LNPs配方中的摩尔比。具体如下:对含不同端基(甲氧基OMe/羟基OH-PEG)/比例(1.5%/3%)PEG脂质的LNP进行体内性能的研究,以靶向肝细胞的特异性低密度脂蛋白(LDL)载脂蛋白B(ApoB)的siRNA(siApoB)为模式siRNA,评价包封siRNA LNP的递送性能。最终筛选得到的脂质处方:SM-102:DSPC:HO-PEG2000-DMG: CHOL =50:10:3:38.5,mol/ mol。
(mRNA-1273脂质处方:SM-102:DSPC:DMG-PEG2000: CHOL =50:10:1.5:38.5,mol/mol)
文中脂质辅料均购自艾伟拓(上海)医药科技有限公司。
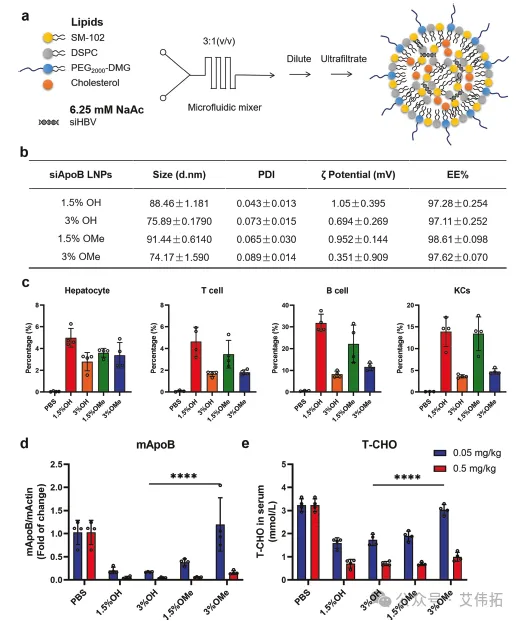
图3 基于LNP的siRNA递送系统的优化
3
siHBV和mIL-2 mRNA共递送系统(tLNP/siHBVIL2)的构建和疗效评价
本研究首先评价tLNP/siHBV在细胞小鼠模型中的抗病毒效果和生物安全性,结果显示tLNP/siHBV未触发细胞因子表达,测定肝内炎症反应相关基因证实tLNP/siHBV的低免疫原性,在单次或多次(5次)给药频率下均呈剂量和时间依赖性,综上tLNP/siHBV具有良好的靶向治疗效果和安全性。基于以上结果,将siHBV与编码小鼠白细胞介素-2(mIL-2)的mRNA共同封装在tLNP中,以增加HBV特异性CD4+和CD8+T细胞反应频率,打破免疫耐受,实现更好的病毒抗原抑制与免疫控制。
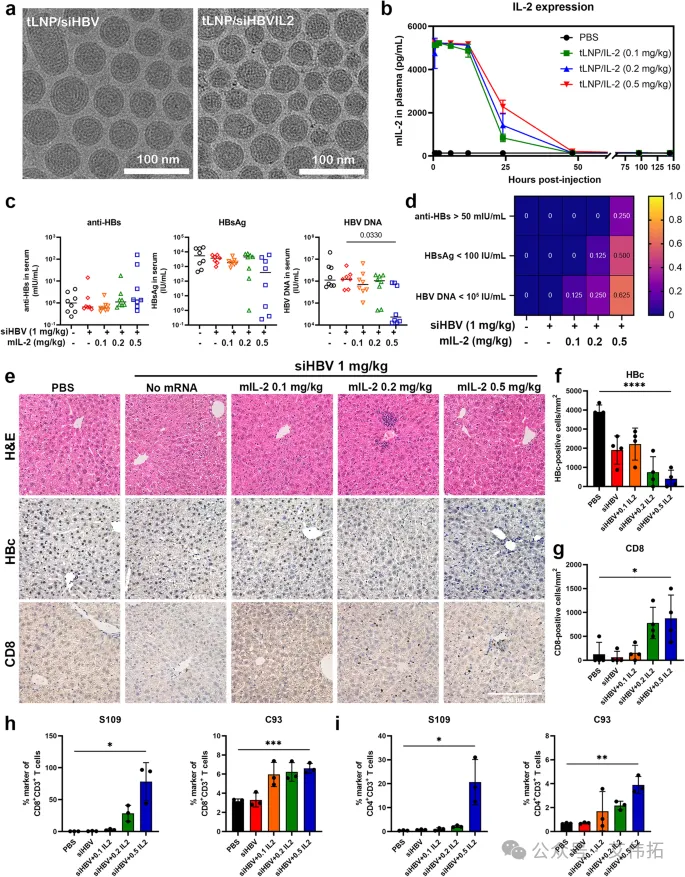
图4 tLNP/siHBVIL2在小鼠模型中的抗病毒效果评价
4
结语
总之,本研究针对HBV全基因组筛选出多功能siRNA组合(siHBV),利用高效安全的tLNP的递送系统实现siHBV和mIL-2 mRNA共递送联合疗法,为进一步治疗CHB提供一种可行的方法,也为LNPs递送系统在核酸药物治疗领域的应用提供新的策略。