艾伟拓(上海)医药科技有限公司
12 年
手机商铺
- NaN
- 0.7999999999999998
- 1.7999999999999998
- 0.7999999999999998
- 3.8
推荐产品
新闻中心/正文
【文献分享】叶酸靶向纳米药物的反思与探索
2482 人阅读发布时间:2024-04-29 10:37
01
叶酸分子在药物靶向递送的“滑铁卢”
主动靶向递送策略早在上世纪八十年代就已提出,旨在递药系统表面修饰特异性的靶向分子,通过识别对应的靶标,引导被修饰的纳米药物跨越生理屏障并增加病灶部位的药物分布。此策略的关键在于寻找合适的“魔法子弹”。其中,叶酸无疑是一个明星分子,常用作修饰在各类药物表面,通过识别肿瘤组织高表达的叶酸受体,实现主动靶向。基于叶酸靶向的文章发表量数以万计。过去50多年里,已有多个叶酸靶向性药物进入临床试验阶段。不幸的是,除了少数用于辅助手术导航的叶酸-探针外,所有的叶酸靶向的治疗药物的临床研究均已失败告终(例如Vintafolide,EC150),给叶酸靶向性药物的临床转化蒙上阴影。在基础研究领域方面,叶酸靶向也存在一定争议,主要体现在体内外结果不一致。体外细胞实验结果很好,但一到体内,靶向效果大打折扣。因此,明晰叶酸分子介导的靶向递送系统在体内递送的过程,揭示其递送相关的调控机制,是助推该类药物新药创制和临床转化的重要环节。
本文将介绍复旦大学占昌友教授和海军军医大学王欢副教授团队近年来在叶酸靶向纳米药物领域的系列工作。
02
缘起:天然IgM的特异性吸附
递药系统在体内的递送过程极其复杂,诸多因素决定了其体内命运。近年来,血浆蛋白对递药系统的作用得到了越来越多的关注。以脂质体为例,脂质体在血液循环过程中,其表面吸附血浆蛋白而形成蛋白冠,进而改变脂质体的表面性质,如通过增加脂质体的粒径、屏蔽表面电位、吸附调理蛋白增强单核巨噬系统的识别等途径负性调控脂质体的体内命运。尤其是主动靶向脂质体,靶分子修饰后可显著增加血浆蛋白在脂质体表面的吸附,严重影响其体内靶向性、药动学、免疫原性等性能。
在团队前期研究中发现,血液中的天然免疫球蛋白M(IgM)会广泛地吸附在各类靶向脂质体表面,导致脂质体快速清除等。其中叶酸脂质体的IgM吸附最高,这就引起了团队的注意。天然IgM主要有两种类型,第一是游离型IgM,即sIgM,通常为五个IgM单体通过二硫键和J链相连构成的五聚体,分子量约为950 kD。含有 10个Fab段和5个Fc段,抗原结合能力和补体激活能力高于IgG。sIgM主要分布在血液中,是机体固有免疫系统的重要组成部分。第二是膜结合型,即mIgM,主要以单体形式表达于B细胞表面,构成B细胞受体复合物,调节着机体的体液免疫功能等。
基于天然IgM与叶酸脂质体的特异性结合,以及天然IgM的生物功能,团队就通过研究叶酸与sIgM和mIgM的相互作用,探索叶酸靶向体内递送的黑匣子。
03
敲响警钟:天然IgM是叶酸靶向递送系统体内性能的关键负调控蛋白
团队首先发现sIgM与叶酸修饰的脂质体有特异性作用,与叶酸的修饰度正相关。这就导致了血液中IgM大量吸附在叶酸脂质体表面,造成了一系列的副作用。
第一,sIgM造成叶酸脂质体的结合活性丧失。通过用人胃癌细胞(SGC-7901,叶酸受体阳性表达)皮下瘤靶向性考察,叶酸修饰并没增加脂质体在肿瘤的靶向,反而增加了脂质体在肿瘤部位巨噬细胞的摄取。
第二,天然IgM的存在,造成了叶酸脂质体在血液中动力学较差。而且存在的加速血液清除(Accelerated Blood Clearance,ABC)现象,提前注射FA-sLip后,血液中产生大量的IgM抗体,造成叶酸脂质体再次注射后,在血液中快速清除,曲线下面积下降近17倍。
第三,天然IgM与叶酸脂质体特异性结合在人血中也是成立的,且结合力强于大小鼠。也会导致sIgM的吸附,激活补体等副作用。鉴于化疗病人体内不同浓度的sIgM浓度,叶酸脂质体药物以后在实际临床给药时一定要格外注意,可以用sIgM作为指标制定合理的给药方案。相关研究成果发表于ACS Nano (2020, 14(11), 14779-14789)。
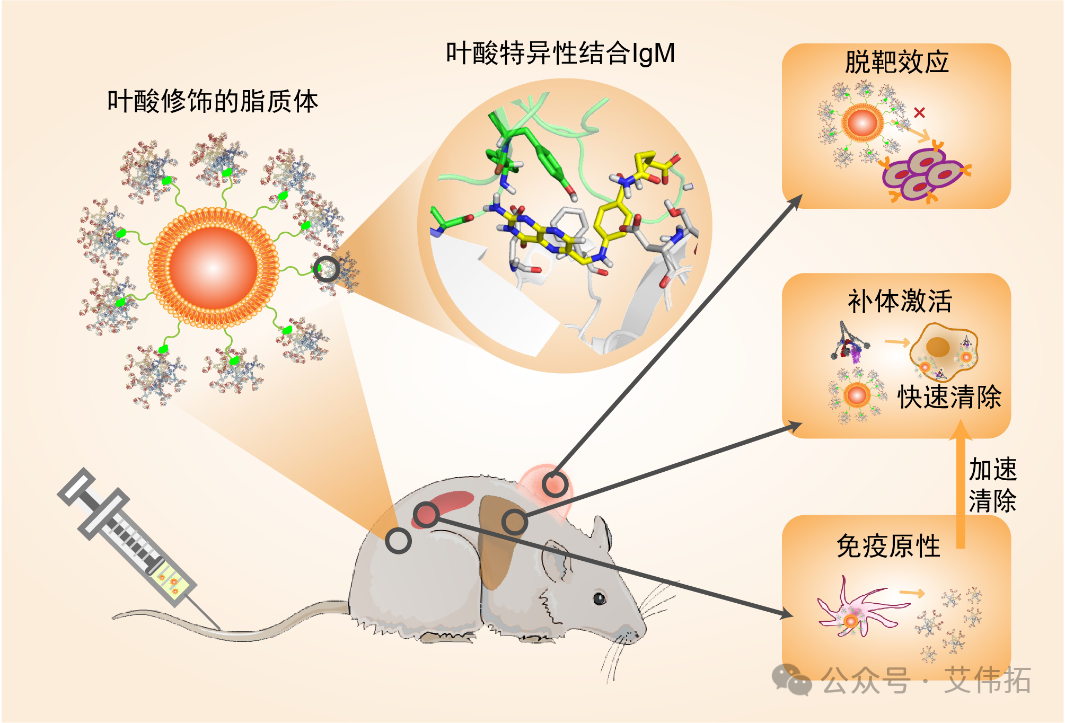
图1. sIgM对叶酸脂质体的体内性能负调控示意图[1]
04
对症下药:脂质纳米圆盘有效改善叶酸靶向递送体内性能
sIgM吸附介导的补体激活是叶酸脂质体性能差的关键原因,那就对症下药。团队巧妙利用纳米圆盘独特的形貌特点,将其吸附的IgM限制在纳米圆盘狭窄的边缘区域,导致sIgM无法呈现抗原结合状态,隐藏其与补体蛋白C1q的结合部位,抑制其结合补体蛋白的能力,有效规避sIgM吸附导致的补体激活等副作用,显著改善了叶酸靶向载体的体内性能。相关研究成果发表在Nano Lett (2022,22(16): 6516-6522)。
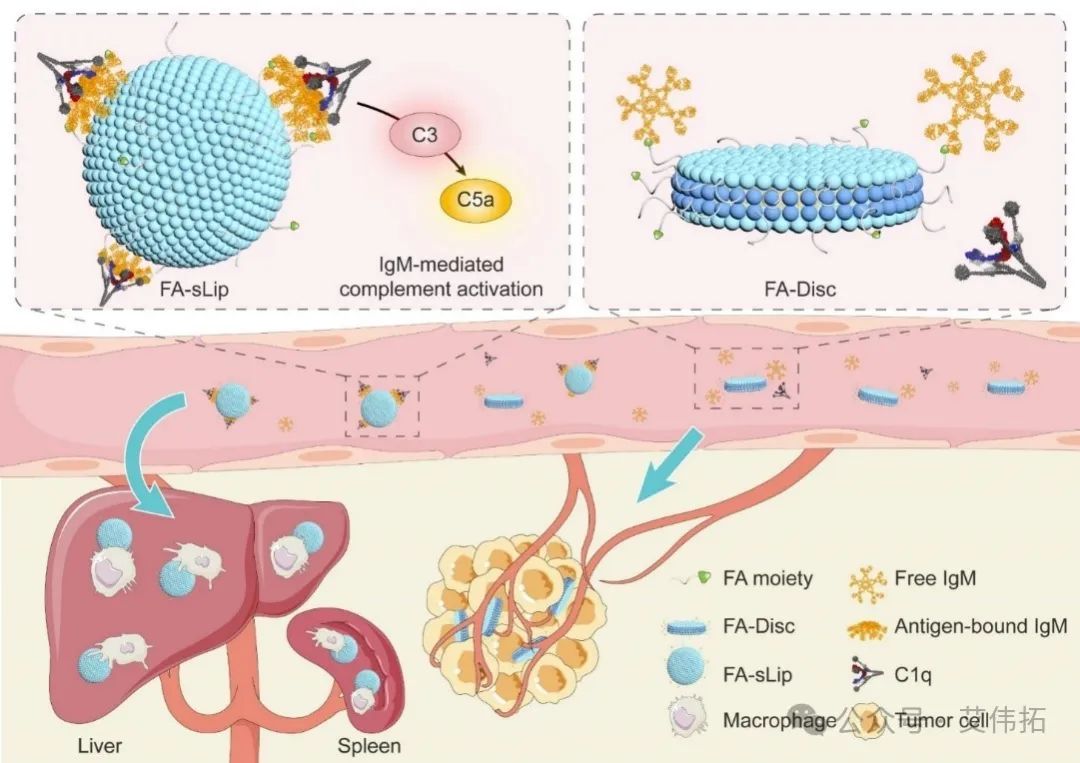
图2. 叶酸脂质纳米圆盘通过规避sIgM介导的补体激活有效改善体内性能示意图[2]
05
因势利导:天然IgM赋能纳米疫苗高效抗原递送
sIgM对传统治疗药物的靶向递送具有负调控作用。但免疫原性适当的增强有利于提高疫苗药物的免疫应答。鉴于叶酸纳米颗粒在体内不可避免地吸附IgM以及IgM在免疫应答中的多重功能。团队提出天然IgM“搭便车”策略,因势利导,主动精准调控纳米疫苗表面IgM蛋白冠的结构和功能,赋能纳米疫苗体内靶向脾脏边缘B细胞,从而提高纳米疫苗体内递送效率。相关研究工作发表在J Control Release (2024,368: 208-218)。
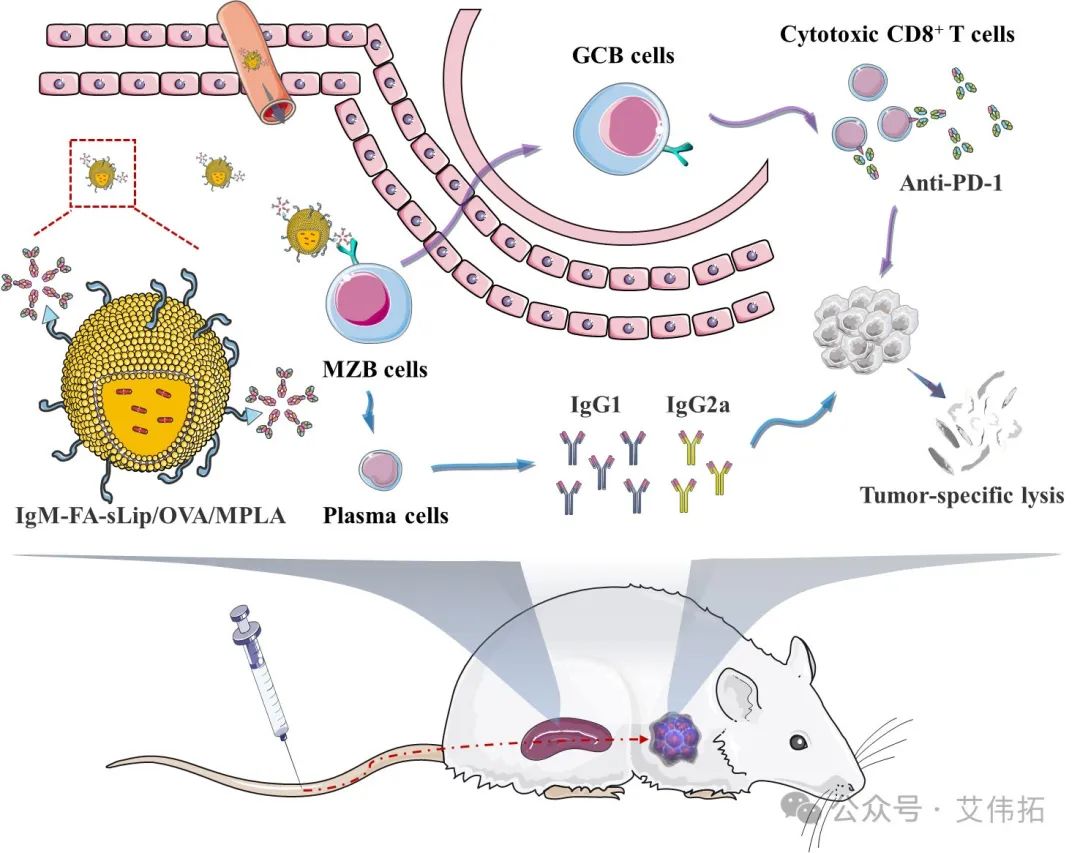
图3. 基于天然IgM搭便车策略的肿瘤纳米疫苗设计及药效机理示意图[3]
06
另辟蹊径:原创性发现叶酸潜在的免疫抑制功能
团队发现了叶酸与IgM的Fc结构域的特异性结合,从而使FA靶向脾脏边缘B细胞的mIgM-BCR复合物。叶酸可通过破坏mIgM-BCR复合物的稳定性、阻断抗原信号的传递来诱导B细胞失能,从而干扰免疫反应。口服叶酸,或者将叶酸直接与生物大分子药物共价结合可诱导免疫逃避,缓解生物大分子药物抗药抗体的产生。该研究利用叶酸作为一种安全有效的免疫抑制剂,为改善治疗性生物制剂的临床疗效开辟了一条新途径。相关研究工作以封底文章发表在Acta Pharm Sin B (2024:14(2):808-820)。
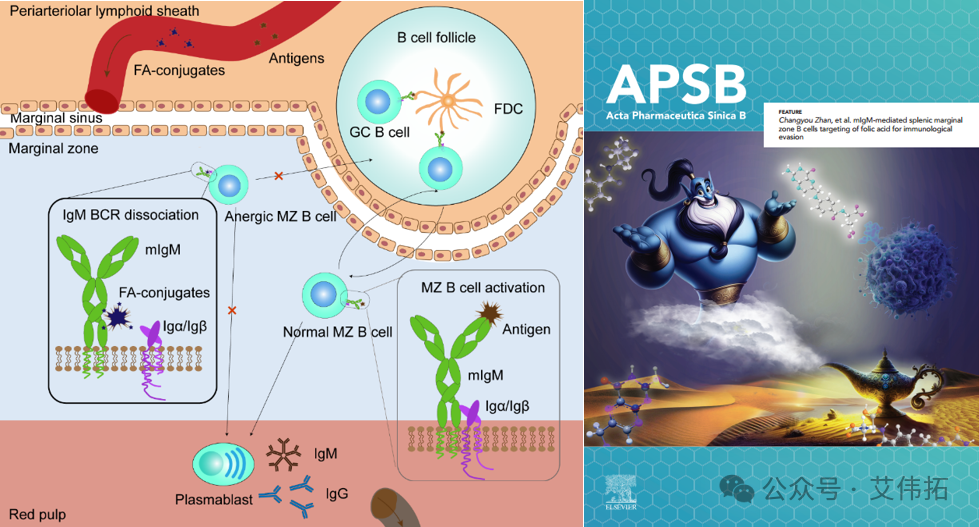
图4. 叶酸分子诱导B细胞失能机理示意图[4]
07
结语
团队近年来一直围绕天然IgM与叶酸及其修饰药物的免疫互作开展研究,相关学术思想也以综述形式发表在Adv Sci (2023,10(20):e2301777)。团队提出天然IgM可作为关键血浆蛋白指导叶酸靶向的药物创新与精准用药,并且系列工作在一定程度上填补了纳米药物体内递送研究的理论体系空白。
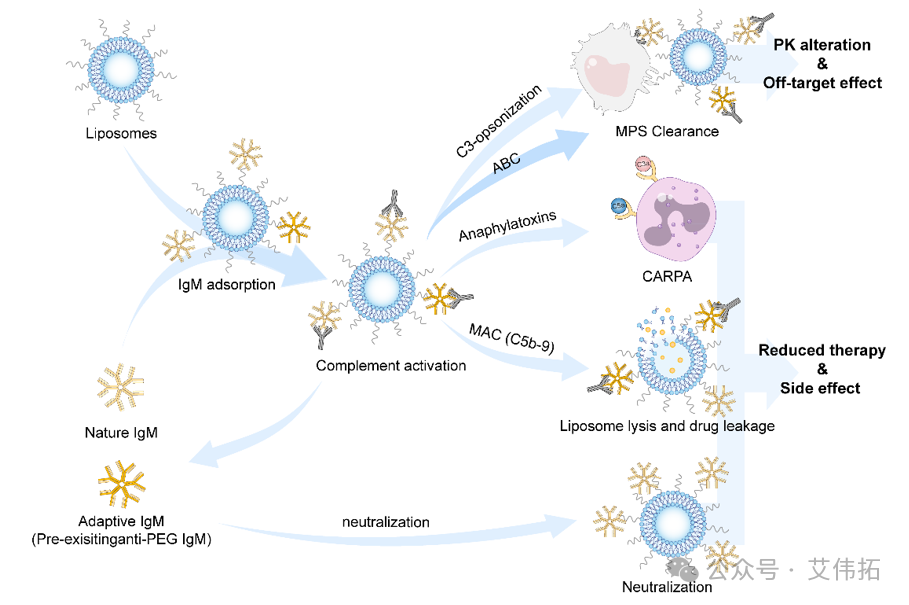
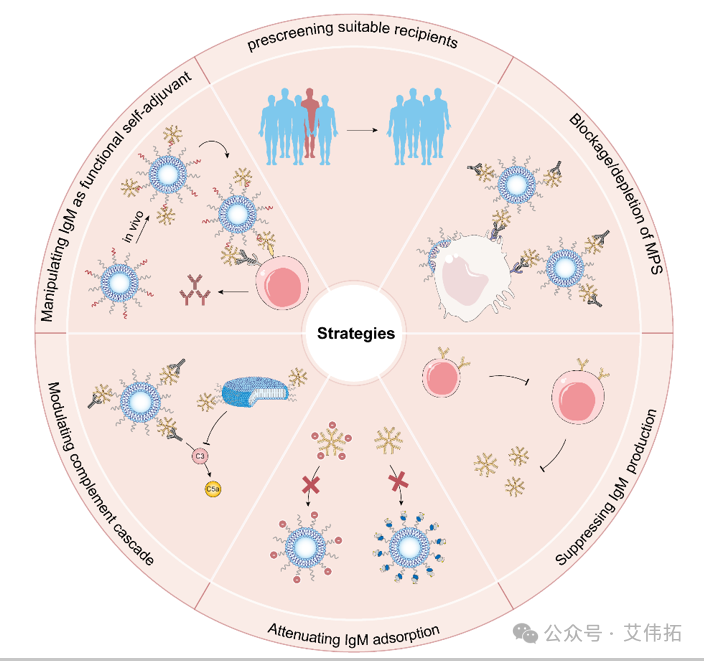
图5. 天然IgM可作为关键血浆蛋白指导叶酸靶向的药物创新与精准用药[5]
系列研究均使用了艾伟拓提供的高品质药用级磷脂。自2007年成立以来,艾伟拓始终致力于服务中国制剂产业,为高端制剂提供特种辅料和高品质服务。已建成100+品种药用辅料产品库,其中40+已完成CDE登记,16个品种已通过关联审评应用于已上市注射制剂中。
经过近20年潜心深耕,艾伟拓已实现脂质体/核酸递送领域的全辅料供应,有力支持国内复杂制剂的研发生产与中外申报,欢迎来询!
艾伟拓,核酸递送/脂质体全辅料供应!

艾伟拓产品团队将持续为您分享艾基金高分文献解读,尽请期待!
参考文献
1. Wang Huan#, Ding Tianhao#, Guan Juan, Liu Xia, Wang Jin, Jin Pengpeng, Hou Shuangxin, Lu Weiyue, Qian Jun, Wang Weiping, Zhan Changyou*. Interrogation of Folic Acid-Functionalized Nanomedicines: The Regulatory Roles of Plasma Proteins Reexamined. ACS Nano 2020, 14(11): 14779-14789.
2. Wang Huan#, Lin Shiqi#, Wang Songli, Jiang Zhuxuan, Ding Tianhao, Wei Xiaoli, Lu Ying, Yang Feng, Zhan Changyou*. Folic Acid Enables Targeting Delivery of Lipodiscs by Circumventing IgM-Mediated Opsonization. Nano Lett 2022,22(16):6516-6522.
3. Wang Huan#, Wu Xiying#, Sun Yuhan#, Liu Anze, He Yingying, Xu Ziyi, Lu Ying*, Zhan Changyou*. A natural IgM hitchhiking strategy for delivery of cancer nanovaccines to splenic marginal zone B cells. J Control Release 2024,28;368:208-218.
4. Wang Huan#, Jiang Zhuxuan#, Guo Zhiwei#, Luo Gan, Ding Tianhao, Zhan Changyou *. mIgM-mediated splenic marginal zone B cells targeting of folic acid for immunological evasion, Acta Pharm Sin B 2024, 14(2):808-820.
5. Wang Huan#, Lin Shiqi#, Wu Xiying#, Jiang Kuan, Lu Huiping, Zhan Changyou*. Interplay between Liposomes and IgM: Principles, Challenges, and Opportunities. Adv Sci 2023,10(20):e2301777.
感谢海军军医大学王欢副教授供稿